Los exosomas
Un sistema de defensa tiene sentido si existe un sistema de ataque. El Sistema Inmunitario de la ciencia ortodoxa es una hipótesis para justificar que existen organismos patógenos. No existe demostración científica para ello.
Para la teoría del terreno de Antonie Bechamp, el sistema inmunitario es un sistema de regulación, que elimina toxinas. Se sabe que las bacterias pueden generar toxinas debido a su metabolismo cuando se nutren de restos celulares. Así pues, leucocitos, macrófagos, etc, actúan para eliminar estas toxinas, ya que esa es su función. Asimismo, si el número de bacterias se dispara en alguna parte de nuestro cuerpo, estas células del sistema inmunitario se encargan de eliminarlas, para regular y equilibrar la, llamémosle, microfauna de nuestro organismo. Podríamos decir que nos defiende? Bueno, sí, nos defienden de los daños que se produzcan, pero es más correcto usar la palabra «reguladores», pues regulan nuestro equlibrio. Así pues, si por lo que sea entrase en nuestra sangre algún parásito, como un protozoo o algun hongo, ya sea porque tenemos una herida abierta o por la picadura o mordedura de algún animal, sí se podría decir que las células del sistema inmunitario se combinan para eliminar estos parásitos (que son en realidad tóxicos para nuestro organismo).
Las células liberan biomoléculas de diversa naturaleza a su entorno para comunicarse con las células vecinas. Además de dichas moléculas, secretan también elementos más complejos como las vesículas; estructuras compuestas por bicapas lipídicas con proteínas transmembranales que encierran un contenido hidrofílico. Los exosomas son un subtipo pequeño de estas vesículas (de 30 a 150 nm), producidos por una amplia variedad de tipos celulares incluyendo las neuronas, células tumorales, células epiteliales y células del sistema inmunológico. De entre estas últimas, las células presentadoras de antígeno se han caracterizado como productoras de exosomas con contenido variable, tanto en condiciones de reposo como en aquellas que derivan de su estimulación o maduración. En los últimos años, el estudio de los exosomas ha aumentado debido a que se ha demostrado que dichas vesículas poseen propiedades inmunomoduladoras, razón por la que ostentan un gran potencial en aplicaciones de diagnóstico y desarrollo de terapias en diferentes patologías con componentes inflamatorios.
Introducción
La respuesta inflamatoria es un proceso altamente regulado que integra una compleja red de señales que implican comunicación celular. Dicha comunicación involucra la secreción y la subsecuente detección, mediada por receptores específicos, de distintas biomoléculas como citocinas, quimiocinas e, incluso, distintos tipos de metabolitos. En este sentido, se reconoce la existencia de comunicación intercelular, tanto unidireccional como bidireccional, entre leucocitos y células no inmunológicas durante el inicio, el mantenimiento y la resolución del proceso inamatorio.1 La mayoría de las interacciones entre células del sistema inmunológico que no involucran el contacto directo se dan gracias a citocinas liberadas en respuesta a diferentes estímulos; sin embargo, evidencias recientes demuestran la existencia de un tipo distinto de comunicación intercelular mediado por exosomas; un subtipo de vesículas extracelulares (EV) capaces de regular procesos inflamatorios.
De forma general, las EV son clasificadas de acuerdo con su tamaño y su origen: las EV que se forman y desprenden directamente de la membrana plasmática se nombran como ectosomas; los exosomas difieren de estas vesículas debido a que se derivan de procesos de invaginación de membranas endosomales para formar cuerpos multivesiculares que se fusionarán posteriormente con la membrana plasmática.2
Las vesículas así liberadas poseen un tamaño de 30 a 150 nm y se componen de una bicapa con composición lipídica distintiva, diversas proteínas tanto transmembranales como citoplasmáticas, así como diferentes clases de RNA, incluyendo mRNA, lncRNA y miRNA (Figura 1).3,4,5,6,7
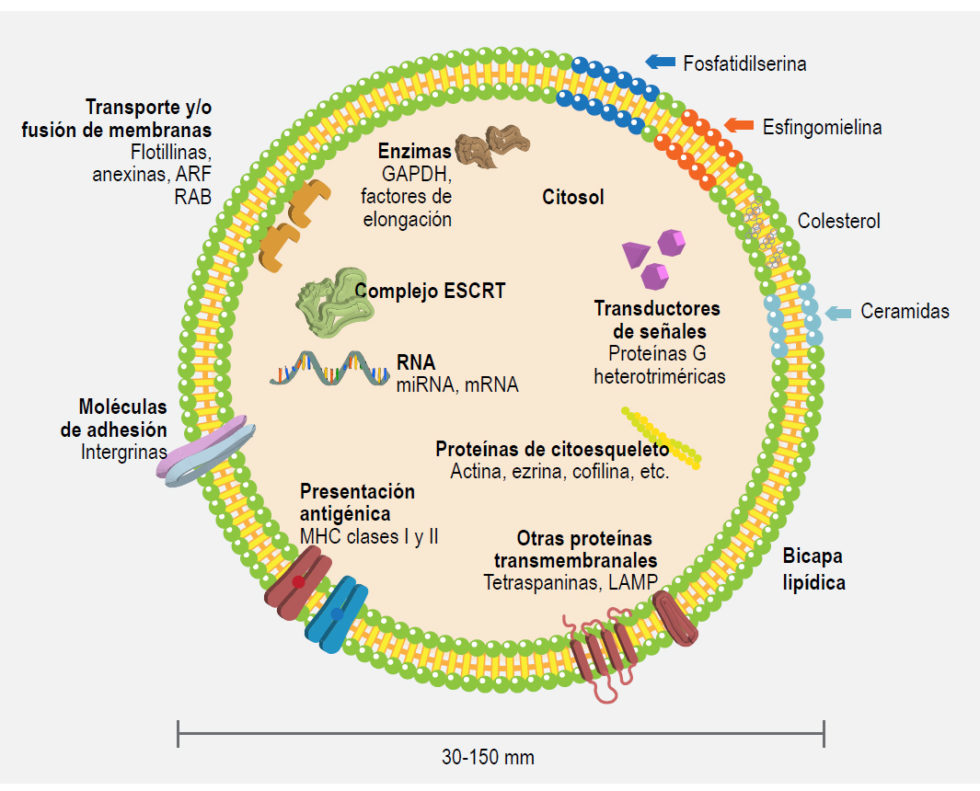
Figura 1. Características y composición de los exosomas. Los exosomas se componen por una bicapa lipídica enriquecida en diversos lípidos, así como diferentes proteínas transmembranales embebidas en dicha estructura. En su interior, estas microvesículas contienen diversas proteínas típicamente citosólicas derivadas de la célula de procedencia con funciones enzimáticas, implicadas en transducción de señales, adhesión, presentación de antígenos o coestimulación y proteínas propias de la génesis exosomal. De igual forma, dicho contenido exosomal incluye usualmente diversos tipos de RNA, incluyendo RNA mensajero (mRNA) así como microRNA (miRNA) y RNA largos no codificantes (lncRNA).
Algunas proteínas altamente enriquecidas en exosomas son empleadas como marcadores para identificar a estas vesículas, algunos ejemplos incluyen a Hsp70 o las tetraspaninas CD9, CD63 y CD81. Las células emplean a estas nanovesículas como medio de comunicación con células adyacentes o muy distantes entre sí; las moléculas presentes en la superficie de las EV les permiten el reconocimiento de células blanco. Estas vesículas son capaces de inducir procesos de señalización a través de interacciones ligando-receptor, pueden ser internalizadas mediante endofagocitosis o pueden incluso fusionarse directamente con la membrana plasmática de las células blanco, liberando su contenido en el citoplasma de las mismas.7
Los efectos biológicos generados tras la captación de exosomas por parte de las células blanco dependen en gran medida de la naturaleza de las células generadoras de exosomas.8,9 El contenido exosomal varía dependiendo de la fuente y las condiciones fisiológicas de las células que liberan estas nanovesículas: cambios debidos a infección, inflamación o transformación como en el caso de células tumorales e, incluso, cambios inducidos por la presencia de fármacos, pueden influenciar y alterar la composición de los exosomas. Sin embargo, es claro que no todo el contenido de la célula generadora de exosomas se halla presente en estas EV, lo cual sugiere que el proceso de “carga” de las moléculas exosomales se encuentra bien regulado y que puede ser alterado por diversas señales. La variabilidad en las moléculas que presentan los exosomas explica las múltiples consecuencias funcionales que su captación puede ejercer sobre las células blanco, así como su utilidad como biomarcadores. A pesar de que el papel homeostático de los exosomas sigue en discusión, se reconoce su importancia en condiciones patológicas, ejerciendo funciones protectoras durante el desarrollo de diversas enfermedades.10 Para el caso de las células del sistema inmunológico, múltiples funciones de estas EV se han descrito en estudios con células presentadoras de antígeno como macrófagos y células dendríticas (DC).
Función inmunorreguladora de los exosomas.
Funcionalmente, el sistema inmunológico puede dividirse en respuesta inmune innata y adaptativa. La respuesta innata se halla evolutivamente conservada y está presente en todos los organismos multicelulares, mientras que la respuesta adaptativa es exclusiva de vertebrados.11 La activación del sistema inmune innato se encuentra controlada por un número limitado de receptores capaces de reconocer patrones moleculares asociados a patógenos (PAMP) o a daño celular (DAMP).12
Estos receptores de reconocimiento de patrón, como los receptores tipo Toll (TLR), se encuentran codificados en línea germinal.
En el caso de la inmunidad adaptativa, los receptores de antígeno, más allá de esta propiedad, se caracterizan por ser el resultado de procesos de recombinación y mutación somática,13 lo cual resulta en un amplio repertorio de este tipo de receptores presentes en las células más características de este tipo de inmunidad; los linfocitos, tanto T como B.
Los linfocitos B pueden reconocer antígenos de forma nativa, mientras que las células T utilizan el proceso de presentación antigénica para el reconocimiento de los mismos. Las DC, los macrófagos y los propios linfocitos B son células presentadoras de antígeno (APC). Las APC son capaces de internalizar antígenos, procesarlos (degradarlos hasta péptidos en el caso de proteínas) y montarlos sobre moléculas del complejo principal de histocompatibilidad, tanto de clase I (MHC-I) como de clase II (MHC-II), para su presentación a linfocitos T naïve CD8+ y CD4+, respectivamente, desencadenando su activación.14
Los exosomas desempeñan un papel crucial al desplegar complejos MHC-péptido funcionales en su superficie para modular respuestas antígeno específicas de linfocitos T CD4+ y CD8+.15,16 Esta presentación puede ejercerse de forma directa u ocurrir en forma de presentación cruzada. En la presentación directa, los complejos MHC-péptido sobre los exosomas se unen y entrecruzan directamente con receptores antígeno-específicos de células T (TCR).
En el caso de la presentación cruzada, las APC captan antígenos acarreados por exosomas y tras un procesamiento adicional de los mismos, son presentados a células T. La presentación cruzada también puede ocurrir cuando complejos MHC-péptido son transferidos por fusión exosomal a las membranas de DC y posteriormente presentados a linfocitos T.15
Función inmunorreguladora del RNA exosomal
Los análisis de secuenciación de nueva generación de material genético proveniente de exosomas aislados de muestras de plasma humano demuestran la presencia de una amplia variedad de especies de RNA en estas nanovesículas circulantes.17 Dichas variantes incluyen RNA mensajeros y RNA reguladores tales como microRNA (miRNA) y RNA nocodificantes largos.3,18,20
Los estudios de secuenciación de RNA de macrófagos (en reposo comparados con células activadas) demuestran que la inflamación altera importantemente el transcriptoma de dichas células.21 De forma interesante, estudios del mismo tipo llevados a cabo comparando RNA exosomal derivado de macrófagos naïve y estimulados con lipopolisacárido (LPS) indican también alteraciones en el transcriptoma exosomal inducidas por la inflamación. En este sentido, el análisis de vías de señalización implicadas en este proceso muestra cambios significativos, específicamente en aquellas relacionadas con la señalización vía TLR y con la activación de NF-kB, en donde se observan cambios entre los mRNA exosomales de las células naïve comparados con sus correspondientes en células estimuladas con LPS.22
Adicionalmente, se ha reportado que los miRNA miR-21 y miR-29a, secretados por células tumorales, pueden fungir como ligandos de TLR7 y TLR8 en leucocitos, promoviendo así la activación de NF-kB y la secreción de citocinas proinflamatorias.23
Los avances actuales respecto a la secuenciación de RNA (RNAseq) muestran que los miRNA son abundantes en los exosomas.2,5 También se ha descrito que el repertorio de miRNA en exosomas es distinto a aquel que despliegan las células de las que derivan estas nanovesículas. De forma interesante, análisis recientes sugieren que los miRNA son incorporados dentro de exosomas de forma regulada y selectiva.24,25
En este sentido, se han identificado varios procesos y proteínas que median la selección e incorporación de estos RNA en exosomas; algunos de ellos incluyen:
• La implicación de la esfingomielinasa neural 2 (nSMase2), que se observa tras inducir la sobreexpresión de nSMase2 en células epiteliales mamarias. En este caso, se detecta un incremento en la producción de exosomas y en los niveles de miRNA exosomales secretados. De forma opuesta, la inhibición de la expresión de esta proteína correlaciona con la reducción en el número de miRNA exosomales.26
• La contribución de las ribonucleoproteínas heterogéneas nucleares sumoiladas (hnRNP) y motivos específicos de los miRNA. Se reconoce que hnRNPA2B1 es capaz de reconocer el motivo GGAG en la secuencia de miRNA, lo que se asocia con la incorporación de estos últimos en exosomas.27
Un número elevado de repetidos de dicho motivo se halla presente en los miRNA que se encuentran enriquecidos comúnmente en exosomas, como es el caso de los producidos por células T.27
• El papel de la secuencia 3’ de los miRNA. Algunos estudios han implicado que las adenilaciones y las uridilaciones en el extremo 3’ de los miRNA contribuyen directamente a la regulación de la incorporación de estos elementos en exosomas, con lo cual se sugiere la existencia de alguna señal (motivo), aún no identificada en esta región de estos RNA, que controle dicho proceso.28
• La participación del complejo de silenciamiento inducido por miRNA (miRISC). Los miRNA son capaces de interactuar con las proteínas AGO2 y GW182 para conformar el complejo miRISC. Este último ha sido detectado colocalizando con cuerpos multivesiculares existiendo una correlación entre la expresión de AGO2 y la incorporación de miRNA en exosomas; de esta forma, se ha observado que la inhibición en la expresión de AGO2 disminuye la abundancia y la diversidad de miRNA secretados en nanovesículas.29,30
Por otra parte, en la actualidad se reconoce que distintos miRNA son transferidos entre células del sistema inmunológico con consecuencias funcionales que implican generalmente, la regulación de las respuestas inflamatorias. De forma interesante, se ha observado que la transferencia de miRNA entre células T y APC, mediada a través de exosomas, se ve favorecida tras la formación de una sinapsis inmunológica funcional.31
En cuanto a la regulación de la inflamación; diversos miRNA “responsivos” a lipopolisacárido (LPS) poseen múltiples genes “blanco” validados que codifican para proteínas involucradas en señalización vía receptores acoplados a proteínas G, destacando receptores de quimiocinas, señalización vía TLR y en la vía de señalización ejercida por TGF-β.
En un estudio donde se determinaron los perfiles de miRNA presentes en exosomas purificados de dos líneas de APC distintas: RAW 264.7 (macrófagos de ratón) y THP-1 (línea monocítica humana), tanto en reposo como tras estimularlas con LPS, se demostró la variabilidad interespecie en el contenido de estas moléculas en microvesículas respecto al tipo celular y al estado fisiológico celular.22
Igualmente, la estimulación con LPS en las células RAW 264.7 modifica de forma significativa las proporciones de RNA no codificantes presentes en exosomas; la presencia y el incremento de pre-miRNA y snoRNA (RNA nucleolares pequeños) en estas condiciones nos indica que las células receptoras de estos exosomas podrían ser susceptibles de modificaciones epigenéticas temporales que regulen la expresión de genes inflamatorios blanco.32
El influjo de pre-miRNA asociados con eventos inflamatorios en células estimuladas con LPS probablemente se asocia con la necesidad de una respuesta rápida durante la inflamación más que una regulación a nivel transcripcional dentro del núcleo. Los miRNA maduros en este caso pueden mediar la regulación fina en estos procesos al alterar los niveles de mRNA de proteínas asociadas con el fenómeno inflamatorio de forma inmediata. En paralelo, los pre-miRNA que se incorporen representan un segundo evento de regulación que se iniciará posteriormente, después del procesamiento final de estas moléculas. En este sentido, los exosomas poseen la ventaja de mediar la incorporación de proteínas maduras y RNA reguladores ya listos (preformados) para actuar de forma inmediata al interior de la célula receptora.22
Más allá de los miRNA y otros ácidos nucleicos ya mencionados, existen evidencias de la regulación mediada por fragmentos pequeños de mRNA. En cuanto a exosomas, se ha verificado la existencia de estos fragmentos enriquecidos en las regiones no traducidas 3’ (3’UTR) de diversos mensajeros completos cargados en estas microvesículas.33
Estas regiones 3’UTR poseen propiedades reguladoras ya que permiten la interacción de proteínas de unión a RNA que modulan la estabilidad y la eficiencia traduccional de los mensajeros. Dichas regiones también poseen múltiples secuencias blanco para miRNA que guían la asociación del complejo de silenciamiento inducido por RNA (RISC) y que media a su vez, eventos de degradación de los mensajeros y posterior represión traduccional.33
Función inmunorreguladora de las proteínas exosomales
Dentro del proteoma de exosomas se han logrado identificar proteínas citoplásmicas, nucleares, endosomales y membranales.34,35,36 Dentro de estas destacan moléculas típicamente asociadas con tránsito vesicular (Rab GTPasas, SNARE, flotillina y anexinas), proteínas involucradas en la biogénesis exosomal (miembros del complejo ESCRT, ALIX, TSG101, etcétera), tetraspaninas (CD9, CD63, CD81, etcétera), proteínas de choque térmico (HSP70, HSP90, etcétera) y moléculas de histocompatibilidad, tanto de clase I como de clase II.37 Cabe resaltar que los exosomas funcionan importantemente como acarreadores de mediadores solubles tales como las citocinas, una función particularmente relevante para la comunicación intercelular en el sistema inmunológico.38
La mayoría de los estudios con exosomas y su efecto en el sistema inmunológico han sido llevados a cabo en el contexto del cáncer y la autoinmunidad; dentro de estos, se ha prestado mayor atención a la regulación de dichos procesos por parte del sistema inmune adaptativo, aunque recientemente se han empezado a generar datos que apuntan a la participación de los exosomas regulando respuestas inmunes innatas.
Inmunidad innata
Las DC producen exosomas de forma constitutiva; dichas nanovesículas han sido implicadas por algunos estudios en la activación de la respuesta inmune innata (Figura 2).
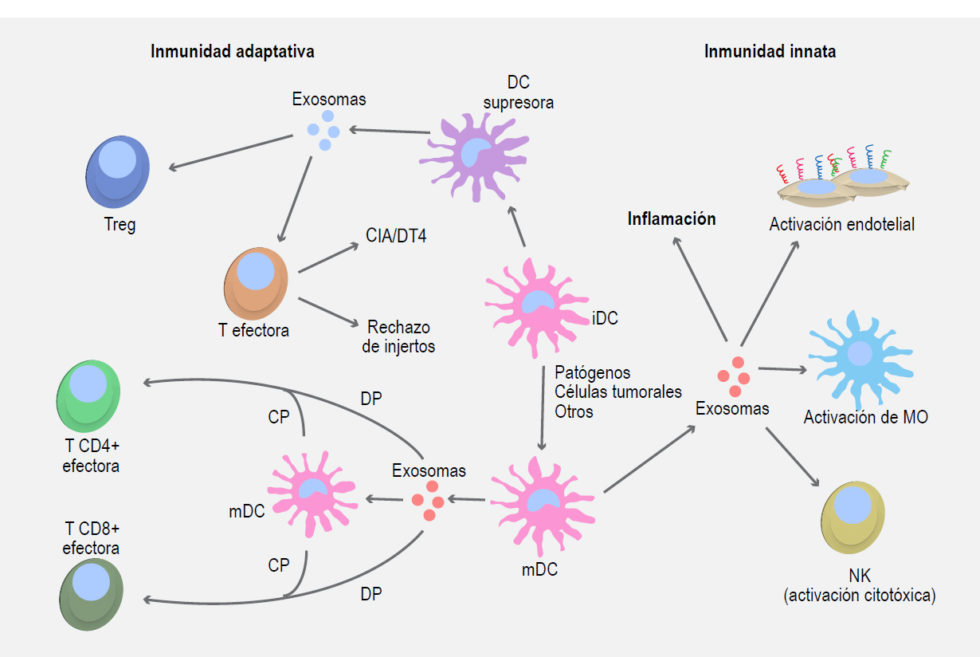
Figura 2. Los exosomas generados por APC modulan las respuestas inmunológicas innatas y adaptativas. Exosomas derivados de DC maduras (mDC) pueden proveer estimulación antigénica a linfocitos T, así como inducir respuestas de tipo innato en diversas células del sistema inmunológico y de otros tipos, promoviendo una respuesta proinflamatoria. En contraparte, lo exosomas liberados por DC inmaduras (iDC) poseen una naturaleza inmunosupresora, siendo capaces de inducir apoptosis en células T efectoras o promover la activación de células con fenotipo regulador (Treg). M0, monocito; NK, célula natural-killer; DP, presentación antigénica directa; CP, presentación antigénica cruzada o cross-presentation; CD, cross-dressing; CIA, artritis inducida por colágeno; DT4, hipersensibilidad tipo 4.
Tanto los exosomas de DC inmaduras (iDC) como aquellos de DC maduras (mDC) contienen en su superficie diversas proteínas pertenecientes a la familia del factor de necrosis tumoral (TNF), incluyendo por ejemplo a TNFα, TRAIL y FasL, mismas que se ha reportado pueden unirse a receptores presentes en células NK para favorecer su actividad citotóxica.2
En este sentido, es interesante resaltar que la actividad de dichas células NK se ve favorecida cuando son estimuladas con exosomas liberados a partir de mDC activadas.39
De forma análoga, otras proteínas presentes en exosomas pueden fungir como ligandos de receptores de células NK, tal es el caso de BAT3, que se puede unir a NKp30 para generar activación celular.40
En otro contexto, las DC activadas con lipopolisacárido (LPS) liberan vesículas extracelulares capaces de estimular la secreción de quimiocinas como IL-8 o RANTES por parte de células epiteliales, un fenómeno relevante durante la patogénesis de afecciones tales como la sepsis. Así también se ha demostrado la actividad de TLR presentes en exosomas provenientes de células estimuladas con LPS en la polarización de macrofagos distales M1 y el aumento de la expresión de genes proinflamatorios (CCL3, IL1B, TNF) y la generación de un estado refractario en la célula distal a través del aumento de TOLLIP.41
Inmunidad adaptativa
La presencia y abundancia de antígenos del complejo principal de histocompatibilidad, tanto de clase I como de clase II (MHC-I y MHC-II), así como de moléculas de coestimulación para células T, en la superficie de los exosomas derivados de DC, macrófagos y linfocitos B representan evidencia de su papel en los mecanismos de presentación antigénica de dichas células. En este sentido, se han propuesto tres posibles mecanismos mediante los cuales los exosomas liberados por APC son capaces de estimular la activación de linfocitos T:
• Presentación cruzada (cross-presentation): los exosomas secretados por una APC dada, que contienen proteínas/péptidos antigénicos, son capturados por APC bystander que posteriormente procesan y presentan estos antígenos valiéndose de sus moléculas de histocompatibilidad MHC-I y MHC-II endógenas (Figura 2), generando la activación de células T específicas.42,43
• Captación exosomal/fusión de membranas (cross-dressing): las APC captan exosomas de otras APC conteniendo complejos MHC-péptido (Figura 2); dichos complejos son incorporados en la membrana de las células receptoras capacitándolas para la presentación a las células CD4+ o CD8+ antígeno-específicas.44,45 Ambos mecanismos requieren la captura de exosomas libres por parte de las APC, en consecuencia, se reconoce la existencia y participación de diversos receptores y moléculas de adhesión en este fenómeno dentro de los cuales se incluyen diversas tetraspaninas, ICAM1, MFG-E8 y fosfatidilserina por mencionar algunos ejemplos.46,47,48
Estas moléculas facilitan la interacción de los exosomas con las APC (y otros tipos celulares) receptoras, tal es el caso de MFG-E8 que interactúa con las integrinas αvβ3 y αvβ5 (ambas con expresión constitutiva en macrófagos y DC humanas), así como con fosfatidilserina.46,47
• Activación directa de linfocitos T por exosomas: debido a su contenido de moléculas MHC-I y MHC-II, así como proteínas de coestimulación, se reconoce que los exosomas derivados de APC, particularmente aquellos secretados por DC, tienen el potencial de activar directamente linfocitos T CD4+ o CD8+ (Figura 2).45,49,50
A pesar de que este mecanismo de estimulación se ha observado principalmente con células T de memoria o células T previamente activadas,51,52 existen evidencias de que los exosomas pueden activar células T naïve de forma directa. Como se mencionó anteriormente, dicho fenómeno de activación requiere la presencia de moléculas de adhesión y de coestimulación en las vesículas, ejemplos de ello son ICAM1 y B7 respectivamente.53
Ejemplos de este papel directo de los exosomas en la activación linfocitaria son estudios que han empleado APC “sintéticas” secretoras de exosomas (transfectadas con MHC-I determinados) capaces de inducir la actividad de células T CD8+ de ratón en un modelo in vitro,53 así como la estimulación directa de linfocitos T CD8+ derivados de PBMC humanas en presencia de exosomas que contienen complejos MHC I-péptido en un modelo de infección viral.48
Es importante mencionar que a pesar de que esta estimulación directa se ha demostrado con estos modelos, existen evidencias de que la actividad estimulatoria de estas vesículas es de entre 10 a 20 veces menos eficiente con respecto a la presentación antigénica ejercida por una APC completa,54,55 sugiriendo que la interacción directa exosoma-célula T no necesariamente representa un mecanismo principal de activación de células T naïve in vivo.
Independientemente del mecanismo de presentación antigénica por parte de los exosomas, la capacidad para estimular células T puede depender del estado de activación de la APC generadora de dichas nanovesículas. Como es de suponer, los exosomas generados por DC maduras poseen mayor cantidad de MHC clase II, ICAM1 y moléculas de coestimulación respecto a los producidos por DC inmaduras,48 un fenotipo que se relaciona con una mayor capacidad activadora. En contraste, los exosomas derivados de DC inmaduras han sido asociados con la generación de anergia en células T, así como la promoción de la activación de células T reguladoras (Treg), por lo que dichas nanovesículas emergen entonces como un posible tratamiento en ciertas enfermedades, particularmente aquellas con un componente autoinmune.56,57
Potencial terapéutico de los exosomas
En años recientes, el uso de DC con fines inmunoterapéuticos para el cáncer y diversas enfermedades con algún componente inflamatorio se ha extendido, sin embargo, la factibilidad de los tratamientos basados en este enfoque se ha visto comprometida debido a las dificultades intrínsecas derivadas del uso de dichas células. En el presente escenario, los exosomas de DC adquieren relevancia debido a su facilidad relativa de manipularse y adaptarse a los procesos regulados de manufactura y almacenaje a largo plazo requeridos o deseados. Adicionalmente, la administración de exosomas reduce enormente los riesgos y complicaciones potenciales derivados de la introducción de células exógenas (o propias pero manipuladas ex vivo) a un individuo dado.11
Existen evidencias claras de la utilidad de exosomas de DC para el tratamiento de cáncer; se ha reportado que los exosomas derivados de DC aisladas de tumores son capaces de inducir la activación de linfocitos T citotóxicos específicos contra el tumor in vivo y que, además, la simple inyección de estas
vesículas en el sujeto enfermo resulta en la disminución del crecimento tumoral o la completa erradicación del mismo en un modelo murino.58 Así, es evidente que los exosomas, al igual que las DC de las que provienen, mantienen su capacidad de presentar antígenos asociados com tumores para activar respuestas específicas dirigidas contra aquellas células que poseen estos antígenos.59,60
Actualmente algunos estudios han demostrado la factibilidad de la producción a gran escala de exosomas derivados de DC, confirmando, además, su perfil de seguridad adecuado durante su administración a pacientes.61 En un ensayo clínico que incluyó pacientes con un estadio avanzado de melanoma, se demostró que tras la administración de una primera generación de exosomas de DC, dichos individuos mostraron un incremento relevante en las respuestas de células NK, no así las que involucran células T específicas.61 La inmunogenicidad limitada de las mencionadas nanovesículas llevó al desarrollo de una segunda generación de exosomas derivados de DC, en este caso obtenidos a partir de células tratadas con INF-γ, que expresan niveles mayores de CD40, CD80, CD86 e ICAM1 respecto a los exosomas de
DC inmaduras, características que, como se ha mencionado, favorecen la inmunogenicidad de estas estructuras.62 Con este precepto, se desarrolló un ensayo clínico fase II, incluyendo pacientes con carcinoma pulmonar de células no pequeñas (NSCLC) no operable. Exosomas de DC tratadas con IFN-γ cargados con antígenos derivados de este tipo de tumor en complejo con moléculas de MHC-I y MHC-II fueron usados a manera de inmunoterapéutico de mantenimiento después de una quimioterapia de inducción.
A pesar de las expectativas de generar actividad antitumoral por parte de células T, este ensayo solo pudo corroborar la exacerbación de la respuesta citotóxica por parte de células NK contra este tipo de tumores.63
Los exosomas derivados de APC también han demostrado ejercer un efecto inmunosupresor en distintos modelos de enfermedad inflamatoria, incluyendo la artritis reumatoide.57 En la artritis inducida por colágeno se ha observado una mejoría en la enfermedad tras la administración de DC transducidas para expresar IL-10 o tratadas con IL-10 recombinante murina.64,65
Con esto en mente, se han desarrollado enfoques para la obtención de exosomas derivados de DC que sobre expresan esta citocina y otras moléculas como IL-4, FasL y la enzima indoleamina 2,3 dioxigenasa (IDO). La administración sistémica de estos exosomas IL-10+ en un modelo de artritis inducida por carragenina en ratones demostró efectividad al frenar la progresión de la enfermedad; un efecto que no pudo ser reproducido en el mismo estudio tras la administración de IL-10 recombinante murina.66 De la misma forma, al generar DC con sobreexpresión de IL-4 se observó la capacidad de estas células para reducir la inflamación en el mismo modelo de artritis inducida en ratón. Al igual que en el caso anterior, los exosomas derivados de estas DC demostraron su efectividad al reducir la incidencia y severidad de la enfermedad inducida tras su administración sistémica, además de que se les atribuyó una mayor eficiencia respecto a dosis repetidas de IL-4 recombinante.64 Consecuencias similares se observaron en el mismo tipo de modelo tras la administración de exosomas derivados de células con sobreexpresión de FasL.65 Por último, para el caso de los exosomas que sobre expresan IDO, se ha reportado que los mismos son capaces de reducir inflamación, inhibir la activación de células T y suprimir las respuestas de estas últimas células contra auto y aloantígenos.67
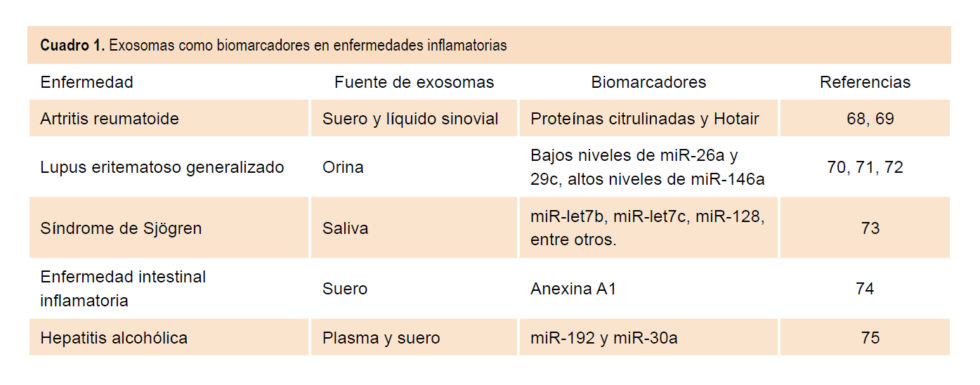
Por otra parte, los exosomas, y particularmente su contenido, pueden ser empleados como biomarcadores para enfermedades inflamatorias. La presencia de exosomas en diversos fluidos corporales, una composición rica en proteínas, diversos RNA y lípidos característicos, así como la plasticidad mostrada por su contenido en respuesta a diversos estímulos hacen de estas vesículas un elemento biomarcador de alteraciones en el estado de salud de un individuo. La utilidad potencial de estas vesículas como fuente de biomarcadores en enfermedades inflamatorias se refleja en los datos mostrados en el Cuadro 1.
Conclusiones
Actualmente existe un enorme interés en dilucidar el papel de los exosomas, tanto en condiciones fisiológicas normales como en el caso de diversas enfermedades. Como se ha descrito, estas nanovesículas resultan de especial interés como potenciales acarreadores terapéuticos de diversas moléculas inmunomoduladoras, debido a que poseen diversas ventajas sobre otros enfoques tales como el empleo de vectores genéticos o liposomas. En este sentido, los exosomas pueden actuar como “nanoacarreadores” naturales membranosos y no tóxicos de diversas biomacromoléculas, particularmente útiles en contextos autólogos. Por otra parte, el contenido de estas estructuras ha sido estudiado ampliamente con miras a su empleo como biomarcadores útiles en el diagnóstico temprano de diversas enfermedades, debido a la naturaleza no invasiva de la su obtención.
Debido a estas razones, el estudio y comprensión de la biología exosomal adquiere relevancia en la futura implementación de estrategias para hacer de la “medicina de precisión” una realidad aplicable a diversas enfermedades.
Agradecimientos
Maravillas-Montero JL et al. Función inmunológica de los exosomas de las células presentadoras de antígeno. Los autores agradecen los donativos a Ismael Martínez Cortés es becario Conacyt número 390987. Asimismo, agradecemos a Ari Kleinberg Bild, David E. Meza Sánchez y Rodrigo Cervantes Díaz, por su apoyo en la preparación del manuscrito.
Referencias
1. Kreuger J, Phillipson M. Targeting vascular and leukocyte communication in angiogenesis, inflammation and fibrosis. Nature Rev Drug Discov. 2016;15(2):125-142. DOI: http://dx.doi.org/10.1038/nrd.2015.2
2. Andaloussi S, Mäger I, Breakefield XO, Wood MJ. Extracellular vesicles: biology and emerging therapeutic opportunities. Nature Rev Drug Discov. 2013;12(5):347-357. DOI: http://dx.doi.org/10.1038/ nrd3978
3. Mittelbrunn M, Gutierrez-Vázquez C, Villarroya-Beltri C, González S, Sanchez-Cabo F, Gonzalez MA, et al. Unidirectional transfer of microRNA-loaded exosomes from T cells to antigen-presenting cells. Nat Commun. 2011;2:282. DOI: http://dx.doi.org/10.1038/ncomms1285
4. Théry C, Ostrowski M, Segura E. Membrane vesicles as conveyors of immune responses. Nat Rev Immunol. 2009;9(8):581-593. DOI: http://dx.doi.org/10.1038/nri2567
5. Valadi H, Ekström K, Bossios A, Sjöstrand M, Lee JJ, Lötvall JO. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol. 2007;9(6):654- 659. DOI: http://dx.doi.org/10.1038/ncb1596
6. Pitt JM, Kroemer G, Zitvogel L. Extracellular vesicles: masters of intercellular communication and potential clinical interventions. J Clin Invest. 2016;126(4):1139-1143. DOI: http://dx.doi.org/10.1172/JCI87316
7. Tkach M, Théry C. Communication by extracellular vesicles: where we are and where we need to go. Cell. 2016;164(6):1226-1232. DOI: http://dx.doi.org/10.1016/j.cell.2016.01.043
8. Sun D, Zhuang X, Zhang S, Deng ZB, Grizzle W, Miller D, et al. Exosomes are endogenous nanoparticles that can deliver biological information between cells. Adv Drug Deliv Rev. 2013;65(3):342-347. DOI: http://dx.doi.org/10.1016/j.addr.2012.07.002
9. Chalmin F, Ladoire S, Mignot G, Vincent J, Bruchard M, Remy-Martin JP, et al. Membrane-associated Hsp72 from tumor-derived exosomes mediates STAT3-dependent immunosuppressive function of mouse and human myeloid-derived suppressor cells. J Clin Invest. 2010;120(2):457-471. DOI: http:// dx.doi.org/10.1172/JCI40483
10. Gangoda L, Boukouris S, Liem M, Kalra H, Mathivanan S. Extracellular vesicles including exosomes are mediators of signal transduction: are they protective or pathogenic? Proteomics. 2015;15(2-3):260-271. DOI: http://dx.doi.org/10.1002/pmic.201400234
11. Zhang B, Yin Y, Lai RC, Lim SK. Immunotherapeutic potential of extracellular vesicles. Front Immunol. 2014;5:518. DOI: http://dx.doi.org/10.3389/fimmu.2014.00518
12. Bianchi ME. DAMPs, PAMPs and alarmins: all we need to know about danger. J Leukoc Biol. 2007;81(1):1-5. DOI: http://dx.doi.org/10.1189/jlb.0306164
13. Vivier E, Malissen B. Innate and adaptive immunity: specificities and signaling hierarchies revisited. Nat Immunol. 2005;6(1):17-21. DOI: http://dx.doi.org/10.1038/ni1153 http://www.revistaalergia.mx Rev Alerg Mex. 2017;64(4):463-477 473 Maravillas-Montero JL et al. Función inmunológica de los exosomas de las células presentadoras de antígeno
14. Théry C, Amigorena S. The cell biology of antigen presentation in dendritic cells. Curr Opin Immunol. 2001;13(1):45-51. DOI: http://dx.doi.org/10.1016/S0952-7915(00)00180-1
15. Greening DW, Gopal SK, Xu R, Simpson RJ, Chen W. Exosomes and their roles in immune regulation and cancer. Semin Cell Dev Biol. 2015;40:72-81. DOI: http://dx.doi.org/10.1016/j.semcdb.2015.02.009
16. Chaput N, Thery C. Exosomes: immune properties and potential clinical implementations. Semin Immunopathol. 2011;33(5):419-440. DOI: http://dx.doi.org/10.1007/s00281-010-0233-9
17. Huang X, Yuan T, Tschannen M, Sun Z, Jacob H, Du M, et al. Characterization of human plasma-derived exosomal RNA by deep sequencing. BMC Genomics. 2013;14:319. DOI: http://dx.doi.org/10.1186/1471- 2164-14-319
18. Koh W, Sheng CT, Tan B, Lee QY, Kuznetsov V, Kiang LS, et al. Analysis of deep sequencing microRNA expression profile from human embryonic stem cells derived mesenchymal stem cells reveals posible role of let-7 microRNA family in downstream targeting of hepatic nuclear factor 4 alpha. BMC Genomics. 2010;11(Suppl 1):S6. DOI: http://dx.doi.org/10.1186/1471-2164-11-S1-S6
19. Nolte-’t-Hoen EN, Buermans HP, Waasdorp M, Stoorvogel W, Wauben MH, ‘t-Hoen PA. Deep sequencing of RNA from immune cell-derived vesicles uncovers the selective incorporation of small non-coding RNA biotypes with potential regulatory functions. Nucleic Acids Res. 2012;40(18):9272-9285. DOI: http:// dx.doi.org/10.1093/nar/gks658
20. Xiao D, Ohlendorf J, Chen Y, Taylor DD, Rai SN, Waigel S, et al. Identifying mRNA, microRNA and protein profiles of melanoma exosomes. PloS One. 2012;7(10):e46874. DOI: http://dx.doi.org/10.1371/ journal.pone.0046874
21. Bhatt DM, Pandya-Jones A, Tong AJ, Barozzi I, Lissner MM, Natoli G, et al. Transcript dynamics of proinflammatory genes revealed by sequence analysis of subcellular RNA fractions. Cell. 2012;150(2):279-290. DOI: http://dx.doi.org/10.1016/j.cell.2012.05.043
22. McDonald MK, Tian Y, Qureshi RA, Gormley M, Ertel A, Gao R, et al. Functional significance of macrophage-derived exosomes in inflammation and pain. Pain. 2014;155(8):1527-1539. DOI: http:// dx.doi.org/10.1016/j.pain.2014.04.029
23. Fabbri M, Paone A, Calore F, Galli R, Gaudio E, Santhanam R, et al. MicroRNAs bind to Toll-like receptors to induce prometastatic inflammatory response. Proc Natl Acad Sci USA. 2012;109(31):E2110-E2116. DOI: http://dx.doi.org/10.1073/pnas.1209414109
24. Stoorvogel W. Functional transfer of microRNA by exosomes. Blood. 2012;119(3):646-648. DOI: http:// dx.doi.org/10.1182/blood-2011-11-389478
25. Squadrito ML, Baer C, Burdet F, Maderna C, Gilfillan GD, Lyle R, et al. Endogenous RNA modulate microRNA sorting to exosomes and transfer to acceptor cells. Cell Rep. 2014;8(5):1432-1446. DOI: http://dx.doi.org/10.1016/j.celrep.2014.07.035
26. Kosaka N, Iguchi H, Hagiwara K, Yoshioka Y, Takeshita F, Ochiya T. Neutral sphingomyelinase 2 (nSMase2)-dependent exosomal transfer of angiogenic microRNAs regulate cancer cell metastasis. J Biol Chem. 2013;288(15):10849-10859. DOI: http://dx.doi.org/10.1074/jbc.M112.446831
27. Villarroya-Beltri C, Baixauli F, Gutiérrez-Vázquez C, Sánchez-Madrid F, Mittelbrunn M. Sorting it out: regulation of exosome loading. Semin Cancer Biol. 2014;28:3-13. DOI: http://dx.doi.org/10.1016/j. semcancer.2014.04.009
28. Koppers-Lalic D, Hackenberg M, Bijnsdorp IV, Van-Eijndhoven MA, Sadek P, Sie D, et al. Nontemplated nucleotide additions distinguish the small RNA composition in cells from exosomes. Cell Rep. 2014;8(6):1649-1658. DOI: http://dx.doi.org/10.1016/j.celrep.2014.08.027
29. Gibbings DJ, Ciaudo C, Erhardt M, Voinnet O. Multivesicular bodies associate with components of miRNA effector complexes and modulate miRNA activity. Nat Cell Biol. 2009;11(9):1143-1149. DOI: http://dx.doi.org/10.1038/ncb1929
30. Zhang J, Li S, Lu L, Li M, Guo C, Yao J, et al. Exosome and exosomal microRNA: trafficking, sorting, and function. Genomics, Proteomics Bioinformatics. 2015;13(1):17-24. DOI: http://dx.doi.org/10.1016/j. gpb.2015.02.001
474 Rev Alerg Mex. 2017;64(4):463-476 http://www.revistaalergia.mx Maravillas-Montero JL et al. Función inmunológica de los exosomas de las células presentadoras de antígeno
31. Dustin ML. Signaling at neuro/immune synapses. J Clin Invest. 2012;122(4):1149-1155. DOI: http:// dx.doi.org/10.1172/JCI58705
32. McCall CE, El-Gazzar M, Liu T, Vachharajani V, Yoza B. Epigenetics, bioenergetics, and microRNA coordinate gene-specific reprogramming during acute systemic inflammation. J Leukoc Biol. 2011;90(3):439-446. DOI: http://dx.doi.org/10.1189/jlb.0211075
33. Batagov AO, Kurochkin IV. Exosomes secreted by human cells transport largely mRNA fragments That are enriched in the 3’-untranslated regions. Biol Direct. 2013;8:12. DOI: http://dx.doi.org/10.1186/1745- 6150-8-12
34. Kowal J, Arras G, Colombo M, Jouve M, Morath JP, Primdal-Bengtson B, et al. Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proc Natl Acad Sci USA. 2016;113(8):E968-E977. DOI: http://dx.doi.org/10.1073/pnas.1521230113
35. Mathivanan S, Fahner CJ, Reid GE, Simpson RJ. ExoCarta 2012: database of exosomal proteins, RNA and lipids. Nucleic Acids Res. 2012;40(Database issue):D1241-D1244. DOI: http://dx.doi.org/10.1093/ nar/gkr828
36. Kalra H, Simpson RJ, Ji H, Aikawa E, Altevogt P, Askenase P, et al. Vesiclepedia: a compendium for extracellular vesicles with continuous community annotation. PLoS Biol. 2012;10(12):e1001450. DOI: http://dx.doi.org/10.1371/journal.pbio.1001450
37. Colombo M, Raposo G, Thery C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annu Rev Cell Dev Biol. 2014;30:255-289. DOI: http://dx.doi.org/10.1146/ annurev-cellbio-101512-122326
38. Yáñez-Mo M, Siljander PR, Andreu Z, Zavec AB, Borràs FE, Buzas EI, et al. Biological properties of extracellular vesicles and their physiological functions. J Extracell Vesicles. 2015;4:27066. DOI: http:// dx.doi.org/10.3402/jev.v4.27066
39. Munich S, Sobo-Vujanovic A, Buchser WJ, Beer-Stolz D, Vujanovic NL. Dendritic cell exosomes directly kill tumor cells and activate natural killer cells via TNF superfamily ligands. Oncoimmunology. 2012;1(7):1074-1083. DOI: http://dx.doi.org/10.4161/onci.20897
40. Simhadri VR, Reiners KS, Hansen HP, Topolar D, Simhadri VL, Nohroudi K, et al. Dendritic cells release HLA-B-associated transcript-3 positive exosomes to regulate natural killer function. PloS One. 2008;3(10):e3377. DOI: http://dx.doi.org/10.1371/journal.pone.0003377
41. Srinivasan S, Su M, Ravishankar S, Moore J, Head P, Dixon JB, et al. TLR-exosomes exhibit distinct kinetics and effector function. Sci Rep. 2017;7:41623. DOI: http://dx.doi.org/10.1038/srep41623
42. Montecalvo A, Shufesky WJ, Stolz DB, Sullivan MG, Wang Z, Divito SJ, et al. Exosomes as a shortrange mechanism to spread alloantigen between dendritic cells during T cell allorecognition. J Immunol. 2008;180(5):3081-3090. DOI: http://dx.doi.org/10.4049/jimmunol.180.5.3081
43. Qazi KR, Gehrmann U, Domange-Jordö E, Karlsson MC, Gabrielsson S. Antigen-loaded exosomes alone induce Th1-type memory through a B-cell-dependent mechanism. Blood. 2009;113(12):2673- 2683. DOI: http://dx.doi.org/10.1182/blood-2008-04-153536
44. Théry C, Duban L, Segura E, Véron P, Lantz O, Amigorena S. Indirect activation of naive CD4+ T cells by dendritic cell-derived exosomes. Nat Immunol. 2002;3(12):1156-1162. DOI: http://dx.doi.org/10.1038/ ni854
45. Segura E, Amigorena S, Théry C. Mature dendritic cells secrete exosomes with strong ability to induce antigen-specific effector immune responses. Blood Cells Mol Dis. 2005;35(2):89-93. DOI: http://dx.doi. org/10.1016/j.bcmd.2005.05.003
46. Théry C, Regnault A, Garin J, Wolfers J, Zitvogel L, Ricciardi-Castagnoli P, et al. Molecular characterization of dendritic cell-derived exosomes. Selective accumulation of the heat shock protein hsc73. J Cell Biol. 1999;147(3):599-610. DOI: http://dx.doi.org/10.1083/jcb.147.3.599
47. Véron P, Segura E, Sugano G, Amigorena S, Théry C. Accumulation of MFG-E8/lactadherin on exosomes from immature dendritic cells. Blood Cells Mol Dis. 2005;35(2):81-88. DOI: http://dx.doi.org/10.1016/j. bcmd.2005.05.001 http://www.revistaalergia.mx Rev Alerg Mex. 2017;64(4):463-477 475
48. Segura E, Nicco C, Lombard B, Véron P, Raposo G, Batteux F, et al. ICAM-1 on exosomes from mature dendritic cells is critical for efficient naive T-cell priming. Blood. 2005;106(1):216-223. DOI: http://dx.doi. org/10.1182/blood-2005-01-0220
49. Utsugi-Kobukai S, Fujimaki H, Hotta C, Nakazawa M, Minami M. MHC class I-mediated exogenous antigen presentation by exosomes secreted from immature and mature bone marrow derived dendritic cells. Immunol Lett. 2003;89(2-3):125-131. DOI: http://dx.doi.org/10.1016/S0165-2478(03)00128-7
50. Luketic L, Delanghe J, Sobol PT, Yang P, Frotten E, Mossman KL, et al. Antigen presentation by exosomes released from peptide-pulsed dendritic cells is not suppressed by the presence of active CTL. J Immunol. 2007;179(8):5024-5032. DOI: http://dx.doi.org/10.4049/jimmunol.179.8.5024
51. Muntasell A, Berger AC, Roche PA. T cell-induced secretion of MHC class II-peptide complexes on B cell exosomes. EMBO J. 2007;26(19):4263-4272. DOI: http://dx.doi.org/10.1038/sj.emboj.7601842
52. Admyre C, Bohle B, Johansson SM, Focke-Tejkl M, Valenta R, Scheynius A, et al. B cell-derived exosomes can present allergen peptides and activate allergen-specific T cells to proliferate and produce TH2-like cytokines. J Allergy Clin Immunol. 2007;120(6):1418-1424. DOI: http://dx.doi.org/10.1016/j. jaci.2007.06.040
53. Hwang I, Shen X, Sprent J. Direct stimulation of naive T cells by membrane vesicles from antigenpresenting cells: distinct roles for CD54 and B7 molecules. Proc Natl Acad Sci USA. 2003;100(11):6670- 6675. DOI: http://dx.doi.org/10.1073/pnas.1131852100
54. Raposo G, Nijman HW, Stoorvogel W, Liejendekker R, Harding CV, Melief CJ, et al. B lymphocytes secrete antigen-presenting vesicles. J Exp Med. 1996;183(3):1161-72. DOI: http://dx.doi.org/10.1084/ jem.183.3.1161
55. Vincent-Schneider H, Stumptner-Cuvelette P, Lankar D, Pain S, Raposo G, Benaroch P, et al. Exosomes bearing HLA-DR1 molecules need dendritic cells to efficiently stimulate specific T cells. Int Immunol. 2002;14(7):713-722. DOI: http://dx.doi.org/10.1093/intimm/dxf048
56. Yin W, Ouyang S, Li Y, Xiao B, Yang H. Immature dendritic cell-derived exosomes: a promise subcellular vaccine for autoimmunity. Inflammation. 2013;36(1):232-240. DOI: http://dx.doi.org/10.1007/s10753- 012-9539-1
57. Yang C, Robbins PD. Immunosuppressive exosomes: a new approach for treating arthritis. Int J Rheumatol. 2012;2012:573528. DOI: http://dx.doi.org/10.1155/2012/573528
58. Zitvogel L, Regnault A, Lozier A, Wolfers J, Flament C, Tenza D, et al. Eradication of established murine tumors using a novel cell-free vaccine: dendritic cell-derived exosomes. Nat Med. 1998;4(5):594-600. DOI: http://dx.doi.org/10.1038/nm0598-594
59. Pitt JM, Charrier M, Viaud S, André F, Besse B, Chaput N, et al. Dendritic cell-derived exosomes as immunotherapies in the fight against cancer. J Immunol. 2014;193(3):1006-1011. DOI: http://dx.doi. org/10.4049/jimmunol.1400703
60. Robbins PD, Morelli AE. Regulation of immune responses by extracellular vesicles. Nat Rev Immunol. 2014;14(3):195-208. DOI: http://dx.doi.org/10.1038/nri3622
61. Escudier B, Dorval T, Chaput N, Andre F, Caby MP, Novault S, et al. Vaccination of metastatic melanoma patients with autologous dendritic cell (DC) derived-exosomes: results of thefirst phase I clinical trial. J Transl Med. 2005;3(1):10. DOI: http://dx.doi.org/10.1186/1479-5876-3-10
62. Viaud S, Ploix S, Lapierre V, Thery C, Commere PH, Tramalloni D, et al. Updated technology to produce highly immunogenic dendritic cell-derived exosomes of clinical grade: a critical role of interferon-gamma. J Immunother. 2011;34(1):65-75. DOI: http://dx.doi.org/10.1097/CJI.0b013e3181fe535b
63. Besse B, Charrier M, Lapierre V, Dansin E, Lantz O, Planchard D, et al. Dendritic cell-derived exosomes as maintenance immunotherapy after first line chemotherapy in NSCLC. ncoimmunology. 2016;5(4):e1071008. DOI: ttp://dx.doi.org/10.1080/2162402X.2015.1071008
64. Kim SH, Kim S, Evans CH, Ghivizzani SC, Oligino T, Robbins PD. Effective treatment of established murine collagen-induced arthritis by systemic administration of dendritic cells genetically modified to express IL-4. J Immunol. 2001;166(5):3499-3505. DOI: http://dx.doi.org/10.4049/jimmunol.166.5.3499 476 Rev Alerg Mex. 2017;64(4):463-476
65. Kim SH, Kim S, Oligino TJ, Robbins PD. Effective treatment of established mouse collagen-induced arthritis by systemic administration of dendritic cells genetically modified to express FasL. Mol Ther. 2002;6(5):584-590. DOI: http://dx.doi.org/10.1006/mthe.2002.0712
66. Kim SH, Lechman ER, Bianco N, Menon R, Keravala A, Nash J, et al. Exosomes derived from IL10-treated dendritic cells can suppress inflammation and collagen-induced arthritis. J Immunol. 2005;174(10):6440-6448. DOI: http://dx.doi.org/10.4049/jimmunol.174.10.6440
67. Bianco NR, Kim SH, Ruffner MA, Robbins PD. Therapeutic effect of exosomes from indoleamine 2,3-dioxygenase-positive dendritic cells in collagen-induced arthritis and delayed-type hypersensitivity disease models. Arthritis Rheum. 2009;60(2):380-389. DOI: http://dx.doi.org/10.1002/art.24229
68. Song J, Kim D, Han J, Kim Y, Lee M, Jin EJ. PBMC and exosome-derived Hotair is a critical regulator and potent marker for rheumatoid arthritis. Clin Exp Med. 2015;15(1):121-126. DOI: http://dx.doi. org/10.1007/s10238-013-0271-4
69. Skriner K, Adolph K, Jungblut PR, Burmester GR. Association of citrullinated proteins with sinovial exosomes. Arthritis Rheum. 2006;54(12):3809-3814. DOI: http://dx.doi.org/10.1002/art.22276
70. Perez-Hernandez J, Forner MJ, Pinto C, Chaves FJ, Cortes R, Redon J. Increased urinary exosomal microRNAs in patients with systemic lupus erythematosus. PloS One. 2015;10(9):e0138618. DOI: http:// dx.doi.org/10.1371/journal.pone.0138618
71. Ichii O, Otsuka-Kanazawa S, Horino T, Kimura J, Nakamura T, Matsumoto M, et al. Decreased miR-26ª expression correlates with the progression of podocyte injury in autoimmune glomerulonephritis. PloS One. 2014;9(10):e110383. DOI: http://dx.doi.org/10.1371/journal.pone.0110383
72. Sole C, Cortes-Hernandez J, Felip ML, Vidal M, Ordi-Ros J. miR-29c in urinary exosomes as predictor of early renal fibrosis in lupus nephritis. Nephrol Dial Transplant. 2015;30(9):1488-1496. DOI: http://dx.doi. org/10.1093/ndt/gfv128
73. Tandon M, Gallo A, Jang SI, Illei GG, Alevizos I. Deep sequencing of short RNA reveals novel microRNAs in minor salivary glands of patients with Sjögren’s syndrome. Oral Dis. 2012;18(2):127-131. DOI: http:// dx.doi.org/10.1111/j.1601-0825.2011.01849.x
74. Leoni G, Neumann PA, Kamaly N, Quiros M, Nishio H, Jones HR, et al. Annexin A1-containing extracelular vesicles and polymeric nanoparticles promote epithelial wound repair. J Clin Invest. 2015;125(3):1215- 1227. Disponible en: https://www.jci.org/articles/view/76693
75. Momen-Heravi F, Saha B, Kodys K, Catalano D, Satishchandran A, Szabo G. Increased number of circulating exosomes and their microRNA cargos are potential novel biomarkers in alcoholic hepatitis. J Trans Med. 2015;13:261. Disponible en: https://translational-medicine.biomedcentral.com/ articles/10.1186

